

| Home | HVAC | Zwembaden | Reiniging | Poort automatisering | Contact | Pers | Vacatures |
|---|
>32 jaar ingenieurservaring in industriële en huishoudelijke projecten.
Het beste is maar goed genoeg.
Desinfecteren, ontsmetten van stinkende (warm)waterleidingen en boilers

De warmwaterinstallatie
Een potentiële bron van geurhinder is de klassieke warmwaterboiler (een wateropslagtank met een inhoud tussen 125 en 250 liter). Als de temperatuur van het water niet constant boven de 50°C ligt, dan kunnen er zich kolonies van anaerobe bacteriën ontwikkelen in de warmtewisselaar, waardoor het warme water een onaangename geur en een gele kleur krijgt. Deze bacteriën zijn volkomen onschadelijk voor de gezondheid, maar de geur van het water kan zeer hinderlijk worden.
Men moet er dus over waken dat de watertemperatuur in het boilervat altijd hoger ligt dan 50°C. Om de ontwikkeling van bacteriën door een verlaging van de temperatuur als gevolg van het veelvuldig gebruik van het voorraadvat tegen te gaan, kan men de temperatuur in het vat éénmaal per week gedurende 24 uur naar 70 graden brengen.
1. Ontsmetten met chloordioxide

https://en.wikipedia.org/wiki/Chlorine_dioxide

Chloordioxide wordt hoofdzakelijk (> 95%) toegepast voor het bleken van houtpulp en in mindere mate van bloem. Daarnaast werd het gebruikt als in desinfectiemiddel van drinkwater. In 1944 nam de drinkwaterreiniging van Niagara Falls het in gebruik om in water opgelost fenol te vernietigen. In 1956 stapte de stad Brussel over van chloor op chloordioxide voor de drinkwaterreiniging en daarmee begon de grootschalige toepassing. De stof wordt meestal gebruikt in een vooroxidatiestap om onzuiverheden te vernietigen die anders met chloor trihalogeenmethanen (zoals chloroform) zouden vormen. Deze stoffen zijn potentieel kankerverwekkend. Chloordioxide is ook beter dan chloor bij zuurtegraden boven pH 7 en in aanwezigheid van ammoniak en amines. Verder houdt het de vorming van een biofilm in waterleidingen beter onder controle. Chloordioxide wordt ook veel toegepast in industriële waterreiniging, in koeltorens en in voedselverwerking.
Chloordioxide is minder corrosief dan chloor en houdt de legionellabacterie beter onder de knie. Hetzelfde geldt voor andere ziektekiemen die door het water verspreid worden zoals virussen, bacteriën en protozoa, waaronder de cysten van Giardia en de oocysten van Cryptosporidium.
Het gebruik in drinkwaterzuivering leidt echter wel tot de vorming van chlorieten als nevenproduct. In de Verenigde Staten is er een maximum gesteld van 1 ppm aan deze stof. De Amerikaanse EPA beperkt het gebruik van chloordioxide tot de bewerking van water van relatief hoge kwaliteit of water dat behandeld wordt met coagulanten op basis van ijzer (zoals ijzer(III)fosfaat). Het chloriet wordt namelijk daardoor tot chloride gereduceerd. In Nederland wordt sedert 2005 geen chloor meer gebruikt in drinkwaterzuivering.
Wat zijn de eigenschappen van chloordioxide ?
Chloordioxide (ClO2) is een synthetisch geelgroenig gas met een chloorachtige, prikkelende geur. Het is een neutrale verbinding van chloor. Chloordioxide verschilt sterk van elementair chloor, zowel wat betreft zijn chemische structuur als zijn gedrag. Chloordioxide is een klein, vluchtig en zeer krachtig molecuul. In verdunde waterige oplossingen is het een vrij radicaal. Bij hoge concentraties reageert het krachtig met reductiemidddelen. Het is een onstabiel gas, dat uiteenvalt in chloorgas (Cl2), zuurstofgas (O2) en warmte. Als chloordioxide in aanraking komt met zonlicht foto-oxideert en valt het uit elkaar. De eindproducten bestaan uit chloride (Cl-), chloriet (ClO-) en chloraat (ClO3-).
Bij een temperatuur van –59°C wordt vast chloordioxide een roodachtige vloeistof, bij een temperatuur van 11°C wordt het gasvormig.
De dichtheid van chloordioxide is 2,4 keer groter dan die van lucht. Chloordioxide heeft als vloeistof een grotere dichtheid dan water.
Chloordioxide is goed oplosbaar in water
Een van de belangrijkste eigenschappen van chloordioxide is zijn hoge oplosbaarheid in water. En dan met name in koud water. Chloordioxide hydroliseert niet wanneer het in water terecht komt, maar blijft als een opgelost gas in de oplossing. Het is ongeveer 10 keer meer oplosbaar in water dan chloor. Met behulp van beluchting of koolstofdioxide kan chloordioxide verwijderd worden.
Hoe wordt chloordioxide bewaard?
Chloordioxide kan het beste als vloeistof bij een temperatuur van 4 ºC bewaard worden. Het is dan redelijk stabiel. Chloordioxide kan echter niet te lang bewaard worden, omdat het langzaam uiteenvalt in chloor en zuurstof. Het wordt zelden bewaard als gas, omdat het onder druk explosief is. Als de concentratie chloordioxide in lucht meer is dan 10% is het explosief. In een waterige oplossing is het echter stabiel en oplosbaar. Waterige oplossingen met ongeveer 1% ClO2 (10 g/L) kunnen veilig opgeslagen worden, wanneer ze beschermd worden tegen licht en gekoeld worden bewaard. Als gevolg van de instabiliteit van chloordioxide wordt het zelden vervoerd. Doorgaans wordt het ter plaatse gemaakt.
Hoe wordt chloordioxide geproduceerd?
Omdat chloordioxide onder druk explosief en dus moeilijk te transporteren is, wordt het meestal ter plaatse (in situ) aangemaakt. Het wordt doorgaans gevormd als een waterige oplossing of als een gas. Chloordioxide wordt geproduceerd in zure oplossingen van natriumchloriet (NaClO2), of natriumchloraat (NaClO3). Voor grote installaties wordt voor de productie van chloordioxide ter plaatse vaak natriumchloriet, chloorgas (Cl2), natriumwaterstofchloriet (NaHClO2), zwavel- of waterstofchloorzuur gebruikt.
Bij de productie van chloordioxidegas worden zoutzuur (HCl) of chloor (Cl) samengevoegd met natriumchloriet.
De twee belangrijkste reacties zijn:
Een alternatief is:
Wat zijn de toepassingen van chloordioxide?
De oxidatiepotentiëlen van verschillende oxideermiddelen.
oxidatiemiddel |
oxidatiesterkte |
oxidatiecapaciteit |
ozon (O3) |
2,07 |
2 e- |
waterstofperoxide (H2O2) |
1,78 |
2 e- |
onderchlorig zuur (HOCl) |
1,49 |
2 e- |
onderbromig zuur (HOBr) |
1,33 |
2 e- |
chloordioxide (ClO2) |
0,95 |
5 e- |
De volgende vergelijkingen laten zien wat er gebeurt als chloordioxide een reactie aangaat. Eerst neemt chloordioxide er een elektron bij en reduceert tot een chloriet-ion.
ClO2 + e- ® ClO2-
Het chlorietion ondergaat oxidatie/reductie reacties en wordt een chloride ion.
ClO2- + 4H+ + 4e- ® Cl- + 2H2O
Uit deze vergelijkingen blijkt dat chloordioxide gereduceerd wordt tot chloride, waarbij 5 elektronen worden geaccepteerd. Hieruit blijkt ook waarom er geen gechloreerde verbindingen worden gevormd. Als chloor een reactie aangaat, accepteert het niet alleen elektronen, maar neemt ook deel aan additie en substitutie reacties, waarbij een of meerdere chlooratomen worden toegevoegd aan de stof waar het chloor mee reageert. Een voorbeeld hiervan is de reactie van chloor met fenol. Hierbij worden drie chlooratomen aan fenol toegevoegd waardoor trichloorfenol ontstaat. Chloordioxide is meer geschikt om fenolen te oxideren, omdat hierbij geen chloorreactie plaatsvindt. Het chlooratoom blijft tot er stabiel chloride is gevormd.
Chloordioxide producten
De SuperTab is een meercomponenten tablet, welke toegevoegd aan water, een zeer zuivere chloordioxide (O=Cl=O) oplossing geeft.
Door de SuperTab is het mogelijk zeer eenvoudig lokaal chloordioxide te maken: eenvoudig een tablet aan het water toevoegen.
Doordat de SuperTab geleverd wordt in een 4-laags gesealde folie, is het eenvoudig en veilig geworden om chloordioxide:
Aangemaakte chloordioxide heeft een beperkte stabiliteit (ca. 4-12 weken) De SuperTab biedt de unieke mogelijkheid altijd over ‘verse’ chloordioxide te beschikken. Hoewel in de naam chloordioxide ook het woord chloor voorkomt, is het product niet te vergelijken met chloor. Een enkel atoom maakt in een molecuulstructuur een wereld van verschil. Een dergelijk verschil is vergelijkbaar met bijv. waterstof. Dit is een zeer explosief gas. Maar als het verbonden is met zuurstof, wordt het water. Chloordioxide is erg effectief in het afdoden van ziekteverwekkers, zoals schimmels, bacteriën en virussen.
Chloordioxide is een zeer selectieve oxidant, vanwege zijn lage oxidatiekracht. Andere oxidanten, zoals chloor en ozon, reageren met de meeste organische verbindingen. Chloordioxide daarentegen reageert slechts met zwakkere organische verbindingen en wordt daardoor niet snel verbruikt. Het resulteert in veel lagere doseringen van chloordioxide om een stabiel residu te creëren, dan bij chloor of ozon het geval is.
Chloordioxide kan vanwege deze selectiviteit goed ingezet worden tegen bacteriën, virussen en schimmels, indien er een hoog gehalte aan anorganische substanties aanwezig zijn. Chloordioxide is zeer goed werkzaam bij lage doseringen (0.1 ppm) en over een groot pH-bereik. Chloordioxide treedt via de bacteriecelwand naar binnen en reageert met de aminozuren in het cytoplasma van de cel, en doodt zo het organisme.
Het bijproduct van de reactie is chloriet, wat hetzelfde is als keukenzout (natriumchloriet) oplossen in water. Het reactieproduct van chloordioxide levert dan ook geen gevaar op voor de gezondheid. Chloordioxide is dan ook een milieu-neutrale techniek omdat het enerzijds de menselijke gezondheid beschermt tegen ziekteverwekkende bacteriën, virussen en schimmels en anderzijds geen bijproducten worden gevormd die veel andere oxidanten wel vormen.
Gecontroleerde afdoding van bacteriën, virussen en schimmels.
Chloordioxide heeft in vergelijking met Chloor en veel andere desinfectietechnieken een groot aantal voordelen. Deze voordelen ontstaan door de unieke combinatie van een lage oxidatiekracht en een hoge oxidatiecapaciteit. Ondanks de lagere oxidatiekracht heeft chloordioxide een betere oxiderende werking dan chloor op bacteriën, sporen en virussen, waarvan sommige niet door chloor bestreden kunnen worden De sporicidale en virucidalewerking van chloordioxide is bij dezelfde concentratie beter als die van chloor.
De vorming van ongewenste en schadelijke bijproducten (zoals Trihalogeenmethaan (THM) en andere halogeenverbindingen) wordt bij chloordioxide vermeden Geur- en smaakstoffen in het water, die door bijv. fenolen, algen of hun ontbindingsproducten ontstaan, worden door chloordioxide geoxideerd en in geur- en smaakneutrale stoffen omgezet.
De kiemdodingssnelheid van chloordioxide neemt, in tegenstelling tot chloor, bij stijgende pH niet af. Chloordioxide verandert de pH-waarde van het water niet. In tegenstelling tot chloor, behoeft geen zuur te worden toegevoegd om de pH-waarde te corrigeren. Met ammonium of aminoverbindingen gaat chloordioxide geen reactie aan. Dat is een wezenlijk onderscheid met chloor, die met ammonium gebonden chloor (chloramine) vormt, die een negatieve invloed hebben op de desinfectie van het te behandelen water.
Chloordioxide is zeer stabiel in het water. Als een residu chloordioxide aanwezig is, wordt dit overschot gedurende lange tijd gehandhaafd, zodat zelfs met uitgebreide leidingnetten en tanks, een herbesmetting van het water effectief wordt tegengegaan.
Chloordioxide breekt effectief biofilm af in tegenstelling tot chloor. Biofilm is een laag micro-organismen welke in een matrix zitten en vormt zich op oppervlaktes welke in contact staan met water. Pathogenen kapselen zich in de biofilm en fungeert zo als een veilige haven voor deze pathogenen (zoals listeria, E. coli en legionella). Zo zijn ze voor biocides vrijwel niet bereikbaar, terwijl als ze vrij zweven in het water wel door de biocide bestreden worden. Vanuit de biofilm kunnen ze zich eenvoudig vermeerderen en kan de contaminatie van de pathogenen in het water tot onaanvaardbare niveaus leiden. Het is zonder enige twijfel bewezen dat chloordioxide biofilm verwijdert van (circulatie-)systemen met water en het vormen van biofilm voorkomt, zelfs met een lage concentratie van chloordioxide.

Nodige concentraties chloordioxide ClO2

2. Ontsmetten met 2 componenten chloordioxide:
Ideale stabiliteit: Ideaal om te bewaren, andere kant van de wereld



![]()
2 NaClO2 + Na2S2O8 >> 2ClO2 + 2Na2SO4
TwinOxide® is een uniek en geavanceerd concept waarbij twee componenten (in poedervorm) aan een bepaald volume water worden toegevoegd. De verkregen chloordioxide-oplossing (0.3%) wordt gebruikt als ontsmettingsmiddel en oxidant in tal van toepassingen. Zelfs in lage concentraties kan het vrijwel elk type micro-organisme in water beheersen en is het een effectief middel voor de controle en het verwijderen van biofilms.
TwinOxide is een uniek, geavanceerd afleversysteem met twee solide componenten
TwinOxide genereert een chloordioxide-oplossing die wordt toegepast als een drinkwater desinfectant. Het wordt geleverd als een poeder- of tabletkit van Component A en Component B. Na toevoeging aan water reageert TwinOxide op een stabiele chloordioxide-oplossing. De solide TwinOxide-kits zijn gemakkelijk op te slaan en te distribueren en hebben een houdbaarheid van 5 jaar.
Superieure desinfectie kracht
Er is een aanzienlijk chemisch verschil tussen TwinOxide en chloor- en chloorachtige desinfectiemiddelen. Hoewel chloor in de naam te vinden is, is het product geen desinfectant van het chloortype. Wanneer de TwinOxide-oplossing wordt toegepast, doodt het chloordioxidemolecuul het volledige spectrum van bacteriën, algen, schimmels, sporen, protozoa, gist, methanogenen, virussen, schimmels en biofilm door zijn grote oxidatiecapaciteit. Schoon water kan geïnfecteerd raken in pijpleidingen vanwege biofilm. In tegenstelling tot andere desinfecterende middelen van chloor en chloorachtige desinfectanten, is TwinOxide de perfecte oplossing om biofilm te verwijderen.
Zeer efficiënte dosering en waterdesinfectie
Over het algemeen zal 1 liter TwinOxide 0.3% -oplossing, met een dosering tussen 0,05 – 2,0 ppm, tot 60.000 liter drinkwater desinfecteren.
Milieu
De TwinOxide chloordioxide-oplossing is effectief tegen alle micro-organismen. Het is gemakkelijk te gebruiken, eenvoudig aan te brengen en draagt op een positieve manier bij aan de gezondheid van de mens, omdat TwinOxide water desinfecteert zonder gevaarlijke bijproducten te produceren die ontstaan uit traditionele desinfectiemiddelen.
Het gebruik van TwinOxide veroorzaakt geen belasting van het milieu, omdat de restproducten onschadelijk en verwaarloosbaar zijn. Het product is goedgekeurd volgens ’s werelds strengste nationale wet- en regelgeving.
Door een totaalproces voor waterdesinfectie aan te bieden op basis van TwinOxide, verminderen we het gebruik van chloor en andere traditionele waterdesinfectiemiddelen. Dit draagt bij tot een beter milieu en tot het algemene welzijn van de consument door veiliger en gezonder drinkwater te leveren.
3) Ontsmetten met ter plaatse aangemaakt chloordioxide: High tech.
5 NaClO2 + 4HCl ® 4 ClO2 + 5NaCl + 2H2O
Een nadeel van deze methode is dat het redelijk gevaarlijk is.





4) Tabletten
TwinOxide tabletten.
De twee-componenten desinfecterende tabletten zijn verpakt in een full colour verpakking met een plastic doosje met daarin:
Het pakket is voldoende om 6 x 100 ml chloordioxide te genereren in een concentratie van 1.000 ppm.
TwinOxide is beschikbaar in verpakkingsgrootten voor de bereiding van de verschillende specifieke volumes van 0.3% chloordioxide oplossing.
TwinOxide Component A en TwinOxide Component B voor bereiding van:
5a)Teststrips voor CLO2 chloordioxide 0-10 ppm

I
7b) Rest chloordioxide teststrips, 0- 0.3 ppm

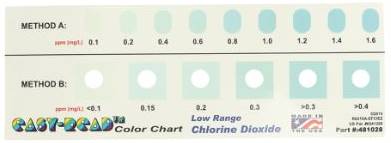
De teststrips zijn een zeer goed en veilig alternatief voor chemische en mechanische testen
7c) Chloordioxide snelle residu check
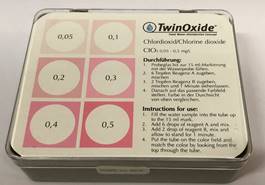
8) Fotometer



"Nous
n’héritons pas la terre de nos ancêtres,
nous l’empruntons à nos enfants" Antoine de St-Exupéry
 Perfecte
technologie, daar komt het op aan
Perfecte
technologie, daar komt het op aan
Versie laatst bewerkt op 26/05/2019